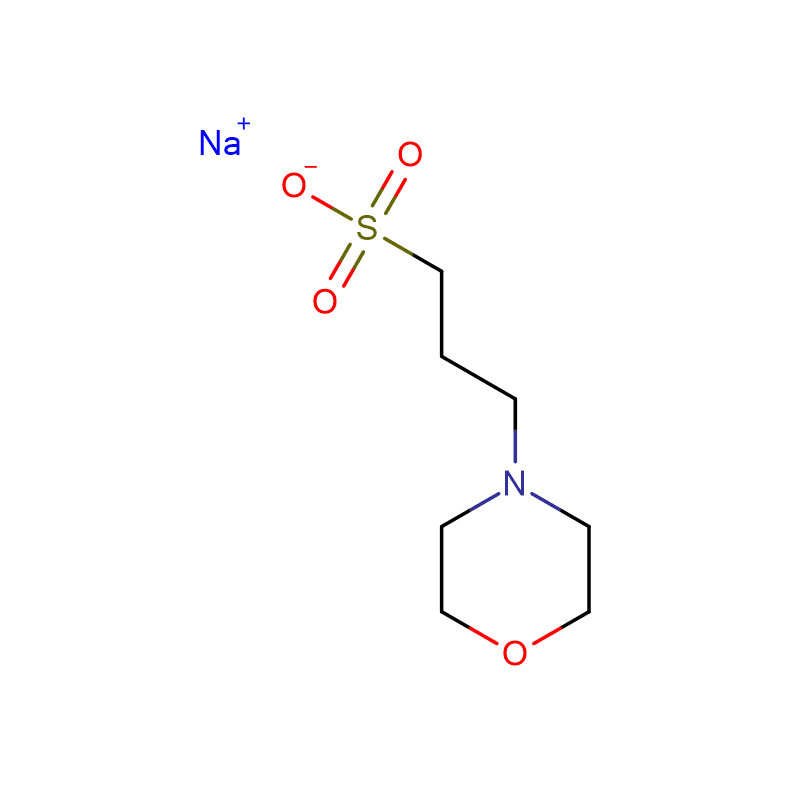
HEPBS Cas:161308-36-7 N-(2-hydroksyetylo)piperazyno-N'-(kwas 4-butanosulfonowy) Biały krystaliczny proszek 99%
| Numer katalogu | XD90100 |
| Nazwa produktu | HEPBS |
| CAS | 161308-36-7 |
| Formuła molekularna | C10H22N2O4S |
| Waga molekularna | 266,36 |
| Szczegóły przechowywania | Otoczenia |
| Zharmonizowany kod taryfowy | 2933599090 |
Specyfikacja produktu
| Wygląd | Biały krystaliczny proszek |
| Asay | ≥ 99% |
| Temperatura przechowywania | Sklep w RT |
| Temperatura topnienia | 211-216°C |
| Współczynnik kwasowości (pKa) | 8,3 (przy 25 ℃) |
Rozumiemy, jak ważna jest ochrona integralności biomolekuł i odczynników za pomocą odpowiednich systemów buforowania.Nasze bufory biologiczne zapewniają stabilność roztworu i kontrolę pH bez zakłócania procesów biologicznych oraz dostarczają niezbędnych soli i składników odżywczych dla komórek i tkanek.Nasze zaawansowane systemy buforowania mogą zapewnić fenomenalną stabilność w hodowli komórkowej, reakcji łańcuchowej polimerazy (PCR), badaniach przesiewowych leków, bioprzetwarzaniu, oczyszczaniu i zastosowaniach końcowych.Wszystkie nasze produkty można skalować od wczesnych badań do zastosowań komercyjnych w różnych stopniach buforowania.Oferujemy liczne konfiguracje opakowań, niestandardowe mieszanie, a nawet płynną recepturę.
Dostarczamy również szeroki wybór wysokiej jakości biochemikaliów w praktycznym zakresie klas oraz w różnych innowacyjnych, przyjaznych dla użytkownika opcjach opakowań.Oprócz gotowych produktów oferujemy niestandardowe wytwarzanie, mieszanie i pakowanie odczynników, aby spełnić Twoje potrzeby.
Zasada działania i wartość pH roztworu buforowego Dodanie pewnej ilości kwasu lub zasady do niektórych roztworów powoduje zahamowanie zmiany pH roztworu, co nazywa się efektem buforowania.Takie rozwiązanie nazywa się roztworem buforowym.Mieszane roztwory słabych kwasów i ich soli (takich jak HAc i NaAc) oraz mieszane roztwory słabych zasad i ich soli (takich jak NH3·H2O i NH4Cl) to roztwory buforowe.Działanie buforujące roztworu buforowego złożonego ze słabego kwasu HA i jego soli NaA na kwas wynika z obecności w roztworze wystarczającej ilości alkaliów A-.Kiedy do tego roztworu dodaje się pewną ilość mocnego kwasu, jony H są zasadniczo zużywane przez jony A-: więc pH roztworu pozostaje prawie niezmienione;po dodaniu pewnej ilości mocnej zasady obecny w roztworze słaby kwas HA pochłania jony OH- utrudniające zmianę pH.



![TAPS-NA Cas:91000-53-2 Ciecz 99% sól sodowa kwasu N-[tris(hydroksymetylo)metylo]-3-aminopropanosulfonowego](http://cdn.globalso.com/xdbiochems/91000-53-2.jpg)