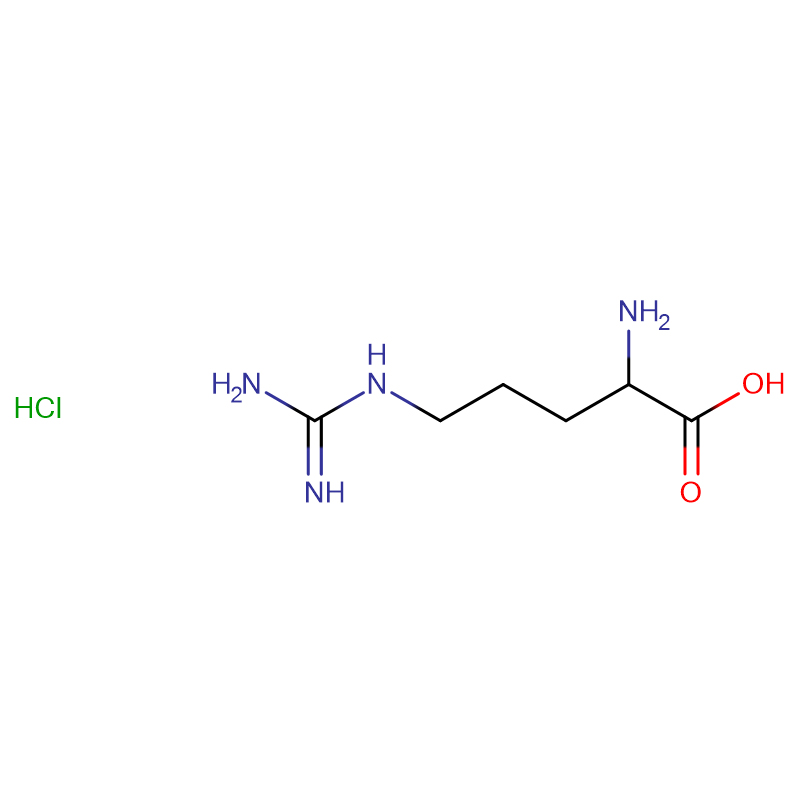
L-arginina CAS:74-79-3 99% Białe kryształy lub krystaliczny proszek
| Numer katalogu | XD90323 |
| Nazwa produktu | L-arginina |
| CAS | 74-79-3 |
| Formuła molekularna | C6H14N4O2 |
| Waga molekularna | 174,20 |
| Szczegóły przechowywania | Otoczenia |
| Zharmonizowany kod taryfowy | 29252900 |
Specyfikacja produktu
| Wygląd | Białe kryształy lub krystaliczny proszek |
| Analiza | 99% |
| Identyfikacja | Absorpcja w podczerwieni |
| Strata przy suszeniu | ≤ 0,5% |
| Czystość chromatograficzna | Znaleziono nie więcej niż 0,5% pojedynczych zanieczyszczeń ; Znaleziono nie więcej niż 2,0% wszystkich zanieczyszczeń |
| Pozostałości po zapłonie | ≤ 0,3% |
| Metale ciężkie ( PB ) | ≤ 0,0015% |
| Żelazo (jako Fe) | ≤ 0,003% |
| Siarczan (jako SO4) | ≤ 0,03% |
| klasa usp | USP 33 |
| chlorek (CI) | ≤ 0,05% |
| Skręcalność właściwa [ α ] D 2 5 | +26,3 ° ~ +27,7 ° |
Mechanizm działania Mycobacterium smegmatis G (MbsG), zależnej od flawiny monooksygenazy l-lizyny, badano w warunkach stanu ustalonego i w warunkach szybkiej reakcji, stosując kinetyczne efekty izotopowe pierwotne i rozpuszczalnika, analogi substratów, efekty pH i lepkości rozpuszczalnika jako sondy mechanistyczne.Wyniki sugerują, że l-lizyna wiąże się przed NAD(P)H, co prowadzi do zmniejszenia stałej szybkości redukcji flawiny.Wiązanie l-lizyny nie ma wpływu na szybkość utleniania flawiny, które zachodzi w procesie jednoetapowym bez obserwacji związku pośredniego C4a-hydroperoksyflawiny.Podobne efekty określono dla kilku analogów substratów.Utlenianie flawiny jest niezależne od pH, podczas gdy profile pH kcat/Km i kred/KD dla NAD(P)H wykazują pojedyncze wartości pKa ~6,0, ze wzrostem aktywności wraz ze spadkiem pH.Przy niższym pH enzym staje się bardziej niezwiązany, wytwarzając więcej nadtlenku wodoru i nadtlenku.Transfer wodorków częściowo ogranicza szybkość przy obojętnym pH i staje się bardziej ograniczający przy niskim pH.Odwrotny wpływ lepkości rozpuszczalnika na kcat/Km dla NAD(P)H zaobserwowano przy obojętnym pH, podczas gdy normalny efekt lepkości rozpuszczalnika obserwowano przy niższym pH.Łącznie wyniki wskazują na unikalny mechanizm, w którym w półreakcji redukcyjnej zachodzi ograniczająca szybkość i wrażliwa na pH zmiana konformacyjna, która wpływa na wydajność hydroksylacji lizyny.