L-histydyna Cas: 71-00-1 98,5% Białe kryształy lub krystaliczny proszek
| Numer katalogu | XD90301 |
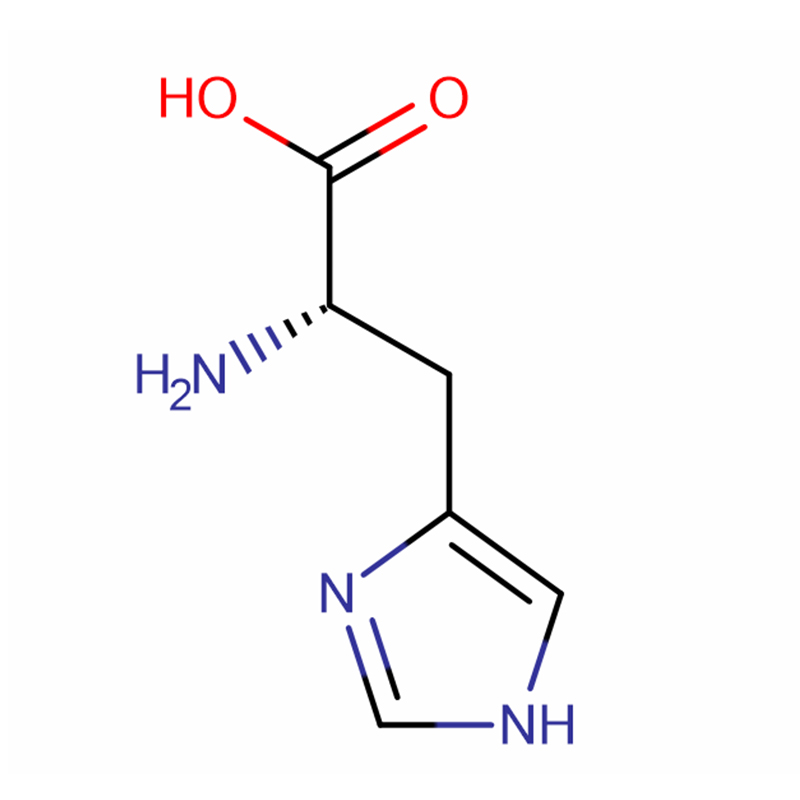
| Nazwa produktu | L-histydyna |
| CAS | 71-00-1 |
| Formuła molekularna | C6H9N3O2 |
| Waga molekularna | 155,15 |
| Szczegóły przechowywania | Otoczenia |
| Zharmonizowany kod taryfowy | 29332990 |
Specyfikacja produktu
| Analiza | 98,5% min |
| Wygląd | Białe kryształy lub krystaliczny proszek |
| Stopień | USP39 |
| Dokładny obrót | +12,6° do +14,0° |
| Identyfikacja | Absorpcja w podczerwieni |
| pH | 7,0 - 8,5 |
| SO4 | <=0,03% |
| Fe | <=30 ppm |
| Strata przy suszeniu | <=0,2% |
| Pozostałości po zapłonie | <=0,1% |
| Cl | <=0,05% |
| Metale ciężkie ( PB ) | <=15 ppm |
| Powiązane związki | Znaleziono nie więcej niż 0,5% pojedynczego zanieczyszczenia;Stwierdzono nie więcej niż 2,0% wszystkich zanieczyszczeń |
Bogate w G sekwencje tworzące kwadrupleksy są nierównomiernie rozmieszczone w ludzkim genomie.Ich wzbogacenie w onkogenne promotory i telomery wzbudziło zainteresowanie celowaniem w G-kwadrupleks (GQ) w terapii przeciwnowotworowej.Tutaj przedstawiamy analizę ilościową konformacji i dynamiki sekwencji tworzących GQ mierzonych za pomocą fluorescencji pojedynczej cząsteczki.Dodatkowo wiążemy te właściwości z ligandami ukierunkowanymi na GQ i wiązaniem białka rezolwazy 1 G4 (G4R1).Nasz wynik pokazuje, że zarówno długość pętli (komponenty inne niż G), jak i sekwencja przyczyniają się do konformacji GQ.Ślady pojedynczej cząsteczki w czasie rzeczywistym ujawniają, że dynamika fałdowania zależy również od składu pętli.Pokazujemy, że małe cząsteczki stabilizujące GQ, N-metylomezoporfiryna IX (NMM), jej analog, NMP i białko G4R1 wiążą się selektywnie z równoległą konformacją GQ.Nasze odkrycia wskazują na złożoność fałdowania GQ regulowanego przez długość i sekwencję pętli oraz sposób, w jaki konformacja GQ określa skłonność do wiązania małych cząsteczek i białek.