IPTG (izopropylo-β-D-tiogalaktozyd) jest analogiem substratu β-galaktozydazy, który jest wysoce indukowalny.Pod indukcją IPTG induktor może tworzyć kompleks z białkiem represorowym, tak że konformacja białka represorowego ulega zmianie, tak że nie można go połączyć z genem docelowym, a gen docelowy ulega skutecznej ekspresji.Jak zatem należy określić stężenie IPTG podczas eksperymentu?Czy im większy tym lepszy?
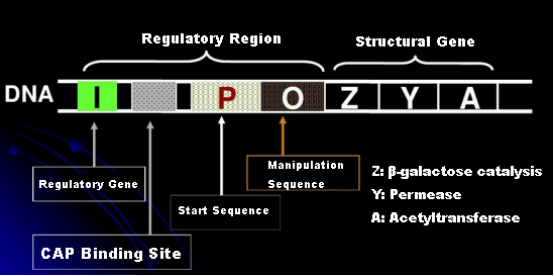
Najpierw zrozummy zasadę indukcji IPTG: operon laktozowy (element) E. coli zawiera trzy geny strukturalne, Z, Y i A, które kodują odpowiednio β-galaktozydazę, permeazę i acetylotransferazę.lacZ hydrolizuje laktozę do glukozy i galaktozy lub do allo-laktozy;lacY pozwala laktozie w środowisku przejść przez błonę komórkową i dostać się do komórki;lacA przenosi grupę acetylową z acetylo-CoA na β-galaktozyd, co wiąże się z usunięciem efektu toksycznego.Ponadto istnieje sekwencja operacyjna O, sekwencja startowa P i gen regulatorowy I. Kod genu I jest białkiem represorowym, które może wiązać się z pozycją O sekwencji operatorowej, tak że operon (meta) jest represjonowany i wyłączony.Istnieje również miejsce wiązania białka aktywatora genu katabolicznego – miejsca wiązania CAP powyżej sekwencji inicjującej P. Sekwencja P, sekwencja O i miejsce wiązania CAP razem tworzą region regulatorowy operonu lac.Geny kodujące trzy enzymy są regulowane przez ten sam region regulatorowy, aby osiągnąć skoordynowaną ekspresję produktów genów.
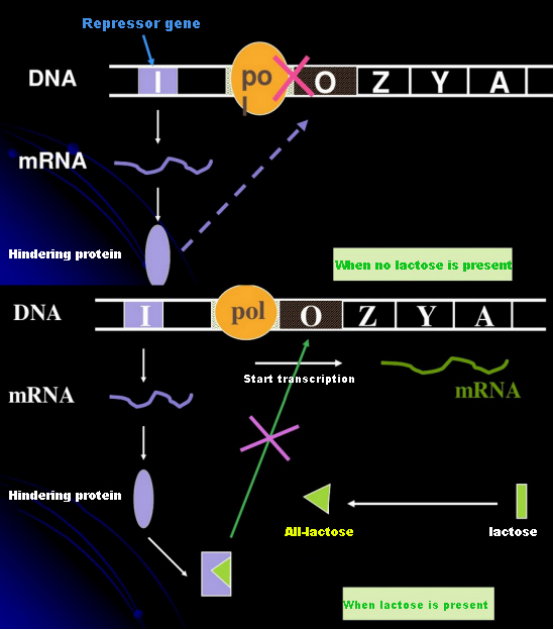
W przypadku braku laktozy operon lac (meta) jest w stanie represji.W tym czasie represor lac wyrażany przez sekwencję I pod kontrolą sekwencji promotora PI wiąże się z sekwencją O, co zapobiega wiązaniu się polimerazy RNA z sekwencją P i hamuje inicjację transkrypcji;gdy obecna jest laktoza, można wywołać operon lac (meta) W tym systemie operonu (meta) prawdziwym induktorem nie jest sama laktoza.Laktoza dostaje się do komórki i jest katalizowana przez β-galaktozydazę w celu przekształcenia w allolaktozę.Ta ostatnia, jako cząsteczka induktora, wiąże się z białkiem represora i zmienia jego konformację, co prowadzi do dysocjacji białka represora z sekwencji O i transkrypcji.Izopropylotiogalaktozyd (IPTG) ma takie samo działanie jak allolaktoza.Jest to bardzo silny induktor, który nie jest metabolizowany przez bakterie i jest bardzo stabilny, dlatego jest szeroko stosowany w laboratoriach.
Jak określić optymalne stężenie IPTG?Weźmy jako przykład E. coli.
Zmodyfikowany genetycznie szczep E. coli BL21 zawierający dodatni rekombinowany pGEX (CGRP/msCT) zaszczepiono płynną pożywką LB zawierającą 50 µg·mL-1 Amp i hodowano przez noc w 37°C.Powyższą hodowlę zaszczepiono w 10 butelkach 50 ml świeżej płynnej pożywki LB zawierającej 50 μg·ml-1 Amp w stosunku 1:100 do hodowli ekspansyjnej, a gdy wartość OD600 wynosiła 0,6 ~ 0,8, dodano IPTG do końcowego stężenia.Jest to 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.Po indukcji w tej samej temperaturze i tym samym czasie pobrano z niej 1 ml roztworu bakteryjnego, a komórki bakteryjne zebrano przez wirowanie i poddano SDS-PAGE w celu analizy wpływu różnych stężeń IPTG na ekspresję białka, a następnie wybierz stężenie IPTG z największą ekspresją białka.
Po eksperymentach okaże się, że stężenie IPTG nie jest tak duże, jak to tylko możliwe.Dzieje się tak dlatego, że IPTG ma pewną toksyczność dla bakterii.Przekroczenie stężenia również zabije komórkę;i ogólnie rzecz biorąc, mamy nadzieję, że im bardziej rozpuszczalne białko ulega ekspresji w komórce, tym lepiej, ale w wielu przypadkach, gdy stężenie IPTG jest zbyt wysokie, powstanie duża ilość inkluzji.Ciało, ale zmniejszyła się ilość rozpuszczalnego białka.Dlatego najbardziej odpowiednim stężeniem IPTG często nie jest im większe, tym lepsze, ale im niższe stężenie.
Celem indukcji i hodowli genetycznie modyfikowanych szczepów jest zwiększenie wydajności docelowego białka i obniżenie kosztów.Na ekspresję genu docelowego mają wpływ nie tylko czynniki własne szczepu i plazmid ekspresyjny, ale także inne warunki zewnętrzne, takie jak stężenie induktora, temperatura indukcji i czas indukcji.Dlatego generalnie przed ekspresją i oczyszczeniem nieznanego białka najlepiej jest zbadać czas indukcji, temperaturę i stężenie IPTG w celu dobrania odpowiednich warunków i uzyskania najlepszych wyników eksperymentalnych.
Czas postu: 31 grudnia 2021 r

