L-Alanina CAS:56-41-7 99% Biały krystaliczny proszek
| Numer katalogu | XD90326 |
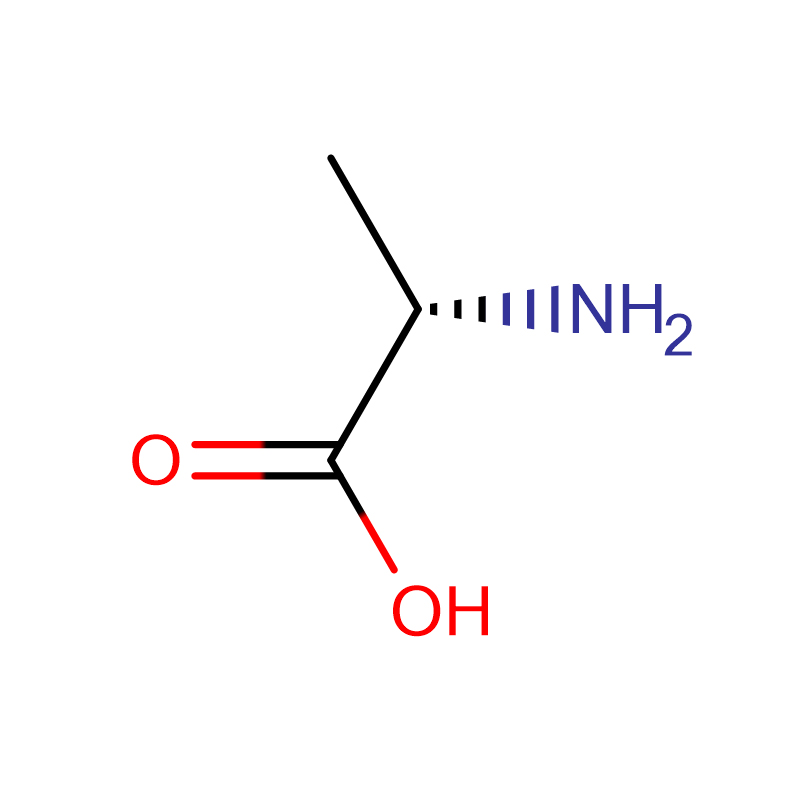
| Nazwa produktu | D-Alanina |
| CAS | 338-69-2 |
| Formuła molekularna | C3H7NO2 |
| Waga molekularna | 89.09 |
| Szczegóły przechowywania | Otoczenia |
| Zharmonizowany kod taryfowy | 29224985 |
Specyfikacja produktu
| Wygląd | Biały krystaliczny proszek |
| Analiza | 98,5 - 101,5% |
| Dokładny obrót | +13,7 do +15,1 |
| Metale ciężkie | <0,0015% |
| pH | 5,5 - 7 |
| SO4 | <0,03% |
| Strata przy suszeniu | <0,2% |
| Żelazo | <0,003% |
| Pozostałości po zapłonie | <0,15% |
| Rozmiar cząsteczki | 200um |
| Cl | <0,05% |
| Poziom trwałych zanieczyszczeń organicznych | Brak zanieczyszczeń |
γ-glutamylotranspeptydazy (γ-GT) rozszczepiają wiązanie γ-glutamyloamidu glutationu i przenoszą uwolnioną grupę γ-glutamylową do wody (hydroliza) lub aminokwasów akceptorowych (transpeptydacja).Te wszechobecne enzymy odgrywają kluczową rolę w biosyntezie i degradacji glutationu oraz w detoksykacji ksenobiotyków.Tutaj podajemy strukturę krystaliczną Bacillus licheniformis γ-GT (BlGT) o rozdzielczości 3Å i jej kompleks z l-Glu.Struktury rentgenowskie potwierdzają, że BlGT należy do N-końcowej nadrodziny hydrolaz nukleofilowych i ujawniają, że białko to posiada szczelinę otwartego miejsca aktywnego podobną do opisanej dla homologicznego enzymu z Bacillus subtilis, ale inną niż obserwowana dla ludzkiej γ-GT i dla γ-GT z innych mikroorganizmów.Dane sugerują, że wiązanie l-Glu indukuje zmianę kolejności C-końcowego ogona dużej podjednostki BlGT i pozwala na identyfikację skupiska reszt kwasowych, które są potencjalnie zaangażowane w rozpoznawanie jonu metalu.Rola tych reszt na stabilność konformacyjną BlGT została zbadana przez scharakteryzowanie autoprzetwarzania, aktywności enzymatycznej, chemicznej i termicznej denaturacji czterech nowych pojedynczych mutantów Ala.Wyniki pokazują, że zastąpienie Asp568 przez Ala wpływa zarówno na autoprzetwarzanie, jak i stabilność strukturalną białka.